Цинк-въздушните батерии са представител на групата на метал-въздушните системи, при които електричеството се генерира от електрохимичната двойка метал (електропозитивен метал) и кислород, който се доставя от въздуха, т.е. единият електрод е кислородът от въздуха, което apriori осигурява по-ниска цена и олекотява системата. Първичните цинк-въздушни батерии са намерили редица комерсиални приложения, както и тези с механично презареждане.
Предизвикателството пред науката и индустрията е разработването на електрически презареждаеми цинк-въздушни батерии. Независимо от интензивните изследвания от началото на 21 век, все още има много проблеми, които трябва да бъдат решени.
Основният проблем пред комерсиализирането на цинк-въздушните батерии e времето на живот (броят на разряд/зарядните цикли), което е свързано с дегрдацията на електродите при циклиране, водещо до бързо понижаване на капацитета им. Независимо от многобройните изследвания, той не е решен еднозначно.
Принципното действие на батерия цинк-въздух е показано на фигурата по-долу. По време на работа металният електрод (анод) се окислява електрохимично от кислорода от въздуха, който от своя страна се редуцира върху въздушния газодифузионен електрод (катод) , създавайки електродвижеща сила. Наличието на практика на един електрод определя възможността за постигане на висока енергийна плътност (1,3 kWh/kg-1). При заряд протича обратният процес, при който се освобождава кислород.
| КАТОД Газо-дифузионен електрод |
АНОД Цинков електрод |
|
|---|---|---|
| Разряд: | О2 + 2H2O + 4е → 4ОН ORR (редукция на кислород) |
Zn + 4OH- → [Zn (OH)4]2- [Zn (OH)4]2- → ZnO + H2O + 2OH- |
| Обща реакция: 2Zn + O2 → 2ZnO | ||
| Заряд: | 4OH- +O2 → 2Н2O + 4е- OER (отделяне на кислород) |
ZnO + H2O + 2OH- → [Zn (OH)4]2- [Zn (OH)4]2- + 2е- → Zn + 4OH- |
| Обща реакция: 2ZnO → 2Zn + O2 | ||
Компоненти на презареждаема Zn-въздушна батерия
Junghye Lee and Ketack Kim, Journal of the Korean Electrochemical Society, Vol. 16, No. 1, 2013, 9-18
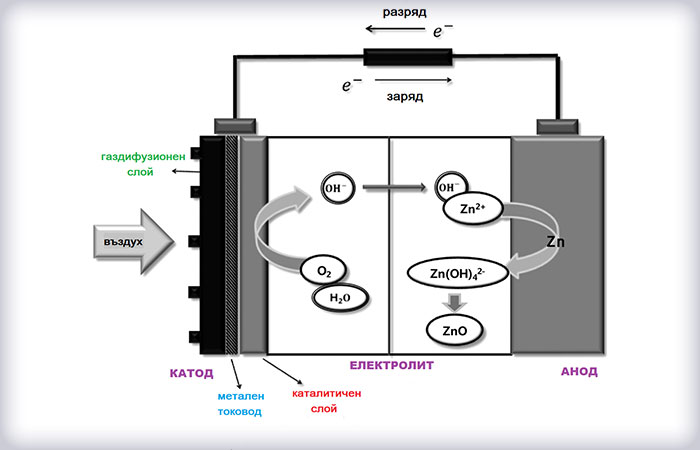
Газо-дифузионният (въздушният) електрод, ГДЕ, е изграден от два слоя – порест газо-дифузионен слой (ГДС), който служи за транспорт на кислорода и каталитичен слой (КС), който осигурява протичането на електрохимичната реакция (редукция на кислород по време на заряд и окисление, т.е. отделяне на кислород при разаряд) в комбинация с метален токовод (неръждаема стомана).
Недостатъци: Основният проблем при газо-дифузионния електрод е високата електрохимична корозия на въглерода при заряд, което силно понижава стабилността на електрода.
Цинков електрод: От групата използвани метали за анод Mg, Zn, Al, Fe, Ca, Li, цинкът, освен че е най-активният метал в алкални електролити, е евтин, нетоксичен, работи във влажна среда и водни електролити, с нисък саморазряд, рециклируем (като ZnO), което прави конструкцията Zn-Въздух семпла, с дълъг „календарен живот“ и „плоска“ разрядна крива.
Недостатъци: Принципни недостатъци на цинковия електрод, някои от които трябва да бъдат преодолени, а други – съобразени с областта на приложимост, са: (1) корозия , т.е. отделяне на водород като паразитна реакция; (2) разтваряне - по време на разряд цинкът се разтваря в електролита КОН до образуване на цинкатни йони [Zn(OH)4]-2, като образуваното съединение дифундира в електролита преди пълното формиране на ZnO, което води до намаляване на капацитета и следователно, съкращава броя на циклите; (3) пасивация на цинка – формирането на пасивационен слой, който деактивира металната повърхност.
Тези слабости на цинк-въздушните батерии, които произтичат от цинковия електрод, могат успешно да се използват в интегрирани системи за акумулиране на енергия, например в комбинация с оловно-кисели батерии, литиево-йонни или метал-хидридни.
Електролит: Най-често използваният електролит е 6-7М воден разтвор на калиева основа (КОН), защото тя има максимална йонна проводимост (640 mScm-1) при температура 25оC, което обуславя бърза кинетика на реакцията на редукция на кислорода. Съществуват също така и неутрални и неводни електролити.
Недостатъци: корозия на цинка (разтваряне на цинковите соли или хидроксиди); утаяване на неразтворими карбонати; изпарение на електролита; отделяне на водород.